这项研究填补了MSC外泌体安全性评价的空白,为再生医学提供了一种安全、有效的潜在治疗工具。
研究证实,在严格控制的生产条件下,即使极高剂量的外泌体也表现出卓越的安全性,这为其临床转化扫除了重要障碍。
把外泌体送进临床,我们走到了哪一站?
文章用0 死亡、0 致残、0 明显组织损伤的硬核数据,首次把无血清、无外源蛋白的 UC/AD-MSC-外泌体推到药品级安全门槛,相当于完成 IND 前毒理的60% 进度。
来源差异的生物学歧义被量化。AD-外泌体促血管因子高 1-2 个 log,但局部免疫信号也略高;未来适应证选择应扬长避短,血管重建选 AD,免疫调节选 UC。
提供了可复制的模板。以蛋白-particles双剂量体系 + 兔-鼠-大鼠三级梯度组合,可在 6 个月内完成一套符合 ICH M3(R2) 的外泌体毒理检查,为国内外申报建立可参考依据。
同时也提醒我们,外泌体不是天生安全,只是剂量窗口宽;当走向大剂量( 1E+12 particles)、长疗程( 3 月)、大动物时,微栓、补体激活、迟发神经毒性仍需一票否决。
看似平淡的结果,给我们几点警示
1. 局部刺激:温度没升 完全无免疫,AD-外泌体组高表达血管区面积扩大 18%,WBC 浸润增加 0.9 倍,p=0.09(边缘显著)。
提示:脂肪来源外泌体携带更高 PDGF-BB/VEGF-A,促血管活性可能放大局部先天免疫,临床肌注或皮损内给药需警惕 红晕 误判。
2. 系统过敏:组胺曲线呈现 首剂冲击-二次峰值-自我回落 的典型脱敏现象,但 Ringer 组亦出现同步波动;IgE 全程无组间差异。
提示:实验环境(检疫应激)本身即可升高组胺,单靠组胺升高不能作为外泌体致敏的阳性终点;未来必须同步监测补体 C3a、SC5b-9 以排除假阳性。
3. 急性毒性:10mg/kg 仍未摸到 LD50,换算到人(70kg) 8.4E+10 particles/kg,远高于已发表临床中位剂量(2E+8~1E+10 particles)。
提示:外泌体的急性安全窗极宽,但大于1E+12 particles时聚集倾向指数级上升,文章未提供 DLS 多分散指数(PDI)数据;若 PDI 0.3,微栓风险可能被低估。
4. 亚慢毒性:AST/ALT、Urea/Cr 无差异,但病理切片仅做到 30天,且未测心脏、肺、脑。
提示:外泌体长期蓄积与迟发神经脱髓鞘、心肌纤维化的数据仍是空白;文章给出的NOAEL为150 g/次( 1.5E+10 particles),若按60kg成人折算 9E+11 particles/次,可作为 IND 申报的起始剂量,但需 6-9 个月大动物 GLP 毒理补足。
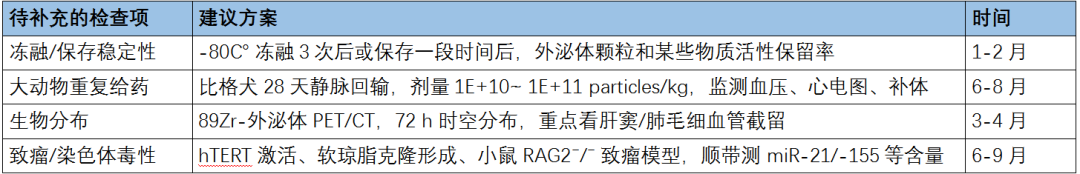
除此之外,还需补充的4个安全检查项
写给产业与监管的一句话
再生医学把外泌体推向高光,但真正的临床级安全是数据磨出来的,不是概念堆出来的。
让子弹再飞一会儿,把该补的安全拼图补全,外泌体才能真正从细胞替代走向药物替代。