来源:BioArt 2025-11-29 09:17
该研究揭示了不同白血病突变如何通过核相分离凝聚体(C-body)这一共同机制驱动疾病发生,为白血病的治疗提供了新靶点。蛋白质网络的空间组织是维持细胞功能有序性的核心机制,既依赖于膜结合细胞器的分区作用,也涉及核仁等无膜生物分子凝聚体的动态调控【1】。核磷蛋白(NPM1)作为核仁形成的关键因子,其定位异常往往反映细胞功能紊乱,并为研究癌症中蛋白质错误定位的致病机制提供了线索。在急性髓系白血病(AML)中,NPM1是最常见的突变基因之一,其突变体(NPM1c)因获得核输出信号而错误定位至胞质,却能异常驱动核内HOXA/MEIS1基因表达程序【2-4】。该程序亦见于其他AML亚型,且这些亚型对MENIN抑制剂等具有共同治疗敏感性,提示不同突变可能通过汇聚于同一致病机制促癌,但其具体关联及关键靶点仍有待阐明。
近日,来自美国贝勒医学院的Joshua A. Riback和Margaret A. Goodell研究团队合作在Cell杂志发表题为Disparate leukemia mutations converge on nuclear phase-separated condensates的研究论文。该研究揭示了不同白血病突变如何通过核相分离凝聚体(C-body)这一共同机制驱动疾病发生,为白血病的治疗提供了新靶点。

研究人员首先利用CRISPR基因编辑技术,在多种NPM1突变白血病细胞系和动物模型中对内源性NPM1蛋白进行荧光标记。通过活细胞成像等技术,他们首次清晰地观察到,突变型NPM1(NPM1c)在细胞核内形成了一种新型的、在生物物理性质上不同于核仁的生物分子凝聚体,并将其命名为 C-body 。重要的是,该结构在原发性患者样本中也得到证实。定量分析表明NPM1c在C-body中的富集度远高于胞质,且细胞周期追踪显示C-body在细胞分裂末期重新组装,并会延迟野生型NPM1(NPM1wt)的核输入,提示其具有动态性和功能主导性。
为了解析C-body的功能,研究人员通过免疫染色和生物物理分析,发现C-body中特异性富集了XPO1(核输出蛋白)、NUP98(核孔蛋白)、KMT2A(组蛋白甲基转移酶)和MENIN等关键调控蛋白,并与活跃的染色质标记共定位。CUT RUN和DNA-FISH实验进一步证实,这些蛋白共同结合在白血病驱动基因(如HOXA簇和MEIS1)的位点上,直接将C-body与异常基因转录联系起来。功能获得和功能丧失实验证明,NPM1c对于C-body的形成及其对上述蛋白的招募既是必要的也是充分的。更重要的是,XPO1抑制剂可溶解C-body,而MENIN抑制剂则能导致MENIN从C-body中耗竭,两者均能有效抑制白血病基因表达并诱导细胞分化,在动物模型和患者原代细胞中均验证了这一效果。
研究人员通过截断突变体系统性地分析了NPM1c各个结构域的功能,发现其多价相互作用是驱动相分离形成C-body的基础。关键证据在于,只有在功能上能够形成C-body的NPM1c变体,才能在体外和小鼠体内维持细胞的未分化状态、驱动白血病相关基因表达并促进白血病发生;而无法形成C-body的变体则会导致细胞分化,失去致瘤能力。这直接证明了C-body的稳定性与白血病细胞的干性维持和增殖能力存在严格的因果关系,是维持恶性表型所必需的。
最后,研究将视野扩展到其他白血病亚型。他们发现由NUP98、KMT2A等基因的多种致癌融合蛋白自身也能在细胞核内形成凝聚体,并且这些凝聚体能够招募与NPM1c的C-body完全相同的蛋白网络(如XPO1、MENIN等)。通过相图分析等生物物理手段,证实这些由不同致癌因子驱动的凝聚体在本质上无法区分。
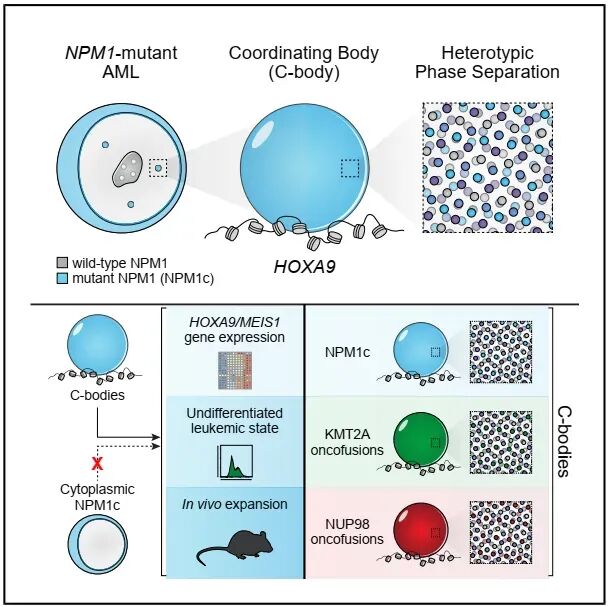
图一 不同白血病突变通过核相分离凝聚体驱动白血病发生
总之,这项工作发现,尽管基因突变的起点不同,但通过形成一种物理性质和作用机制相似的 C-body 来劫持关键的转录调控机器,是急性髓系白血病中一个跨亚型的、汇聚性的致病机制,为开发广谱靶向疗法提供了坚实的理论依据。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(25)01149-3